Учимся решать задачи по химии. Формирование предметной компетентности у обучающихся 8 класса. Программа для установки через Интернет
| Код | СИ-3901 |
| Авторы-составители | Бочарникова Р. А. |
| Издательство | Учитель, 2025 |
| Серия | Образовательные маршруты |
| Электронная версия | скачать |
| УДК | 372.016:54*08 |
Инструкция по оплате и установке электронной продукции через Интернет: ознакомиться.
Покупка одного экземпляра программы дает право её использования на одном ПК.
Предлагаемые задания позволяют использовать их в подготовке к олимпиадам и участии в них, сопровождать обучающихся в освоении ключевого умения научиться учиться, формировании УУД и достижении высоких образовательных результатов.
Предназначено учителям химии, школьникам, рекомендовано студентам педагогических учебных заведений.
Минимальные системные требования:
- операционная система - Windows XP/VISTA/7/8/8.1;
- процессор - Pentium-II;
- оперативная память - 256 МB;
- разрешение экрана - 1024х768;
- свободное место на жестком диске - 400 МB.
С этим товаром покупают
Примеры документов
Нахождение массы вещества в смеси
Нахождение массы вещества в смеси
Задача. Сколько тонн сульфида меди (I) Сu2S получится из 120 т горной породы, содержащей 20 % сульфида меди (I)?
Краткая запись условия задачи:

Решение:
m(Cu2S) =  = 24 т.
= 24 т.
Ответ: 24 т Cu2S.
Задачи для самостоятельной работы.
4. «Нержавейка», из которой изготавливают столовые приборы, содержит до 12 % хрома и до 10 % никеля. Сколько килограммов этих металлов можно получить из 50 кг такой стали?
5. Бронза – сплав на основе меди с добавлением до 20 % олова. Этот сплав идет для изготовления подшипников. Сколько меди и олова по массе содержит 10 кг бронзы?
6. Латунь – сплав меди и цинка, содержащий от 10 до 50 % цинка. Сколько цинка по массе находится в 2 кг латуни, идущей для изготовления мебельной фурнитуры?
7. Взрослый человек должен в сутки потреблять с пищей 3,5 г калия. В 100 г кураги содержится 2 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия? Какова доля калия в 100 г кураги по отношению к суточной потребности человека в калии?
8. 270 мг сплава алюминия содержат 5 % меди. Сколько меди по массе содержит этот сплав?
9. 2,32 т магнитного железняка содержат 5 % пустой породы. Сколько по массе пустой породы содержится в этом железняке?
10. В воде содержится 88,9 % кислорода. Сколько граммов кислорода содержится в стакане воды?
11. В воздухе на долю кислорода приходится 23,15 % по массе. Сколько кислорода содержит 1 кг воздуха?
12. Определите массу оксида вольфрама (VI), которая содержится в 928 кг его технического образца. Массовая доля примесей составляет 25 %.
13. Тело человека на ![]() состоит из воды. Сколько по массе воды в твоем теле?
состоит из воды. Сколько по массе воды в твоем теле?
Определение количества вещества по известной массе вещества
Определение количества вещества
по известной массе вещества
Задача 1. Вычислите количество вещества сульфата алюминия массой 171 г.
Краткая запись условия задачи:

Решение:
M[Al2(SO4)3] = 27 · 2 + (32 + 16 · 4) · 3 = 54 + 96 · 3 = 342 г/моль;
n[Al2(SO4)3] =  = 0,5 моль.
= 0,5 моль.
Ответ: n[Al2(SO4)3] = 0,5 моль.
Задача 2. Как взвесить 5 моль оксида железа (III) Fe2O3?
Краткая запись условия задачи:

Решение:
m = M · n; M(Fe2O3) = 56 · 2 + 16 · 3 = 160 г/моль;
m(Fe2O3) = 160 г/моль · 5 моль = 800 г.
Ответ: на весах взвешиваем 800 г Fe2O3, то есть 5 моль.
Задачи для самостоятельной работы.
14. Верны ли следующие суждения:
А. 56 г азота N2 и 56 г монооксида углерода СО составляют 2 моль азота и 2 моль монооксида углерода.
Б. Одинаковую массу имеют 2 моль водорода Н2 и 1 моль гелия Не.
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
15. Сравните число моль указанных масс разных веществ, вписав знаки > , < или = вместо звездочки. Ответ поясните.
a) Число моль 48 г кислорода О2 * числа моль 44 г углекислого газа СО2, так как _________________________________________________.
б) Число моль 14 г этена С2Н4 * числу моль 14 г азота N2, так как _______________________________________________________________.
в) Число моль 112 г железа * числа моль 112 г меди, так как ___________________________________________________________________.
16. 180 мл воды выпито за 10 глотков. Сколько моль воды содержится в одном глотке воды?
17. Пустую колбу заполнили 22 г углекислого газа СО2. Сколько моль газа содержится в данном сосуде?
18. Что тяжелее:
а) 0,5 моль серы S или 1 моль кислорода О2?
б) 2 моль водорода Н2 или 1 моль азота N2?
в) 0,5 моль оксида меди (II) СuO или 1 моль аргона Ar?
19. Найдите количество вещества:
а) 16 г оксида железа (III) Fe2O3;
б) 17,1 г сульфата алюминия Al2(SO4)3;
в) 108 г воды H2O;
г) 1,07 г гидроксида железа (III) Fe(OH)3;
д) 15,3 г нитрата алюминия Al(NO3)3.
20. Какому количеству вещества соответствуют 40 г сульфата железа (III) Fe2(SO4)3 и 31 г фосфата кальция Ca3(PO4)2?
а) 5 моль и 10 моль; в) 0,1 моль и 0,1 моль;
б) 10 моль и 5 моль; г) 1,2 моль и 0,8 моль.
Вычисление объема и массы вещества по количеству вещества и количеству молекул
Вычисление объема и массы вещества
по количеству вещества и количеству молекул
Задача 1. Какой объем при н. у. имеют 3 · 1023 молекул сернистого газа SO2?
Краткая запись условия задачи:

Решение:
V(SО2) = 22,4 л/моль ·  = 22,4 · 0,5 = 11,2 л.
= 22,4 · 0,5 = 11,2 л.
Ответ: V(SО2) = 11,2 л.
Задача 2. Найти массу 5,6 л бурого газа NO2.
Краткая запись условия задачи:

Решение:
М(NО2) = 14 + 16 · 2 = 14 + 32 = 46 г/моль;
m(NО2) = 46 г/моль ·  = 46 · 0,25 = 11,5 г.
= 46 · 0,25 = 11,5 г.
Ответ: m(NО2) = 11,5 г.
Задачи для самостоятельного решения.
33. Определите количество вещества:
а) 2,8 л при н. у. CO2; Н2; О2; SО2; N2;
б) 1 м3 CO2; Н2; О2; SО2; N2;
в) 11,2 л CO2; Н2; О2; SО2; N2.
34. Определите объем:
а) 5 моль сернистого газа SО2;
б) 12 моль водорода Н2;
в) 0,1 моль кислорода О2;
г) 15 ммоль сернистого газа SО2;
д) 7 кмоль азота N2.
35. Какой объем при н. у. занимают:
а) 3 · 1020 молекул водорода Н2;
б) 18 · 1023 молекул кислорода О2;
в) 24 · 1023 молекул бурого газа NО2;
г) 30 · 1023 молекул монооксида азота NО;
д) 36 · 1020 молекул веселящего газа N2О;
е) 42 · 1020 молекул углекислого газа CO2?
36. Какую массу имеют:
а) 3 л углекислого газа CO2;
б) 12 л водорода Н2;
в) 480 мл сернистого газа SО2;
г) 1 м3метана СН4;
д) 224 мл кислорода О2;
е) 5,6 м3 азота N2;
ж) 400 мл метана СН4?
37. Что тяжелее:
а) 15 л углекислого газаCO2 или 15 л сернистого газа SО2;
б) 2 л углекислого газа CO2 или 3 л угарного газа СО;
в) 3 л метана СН4 или 1 л этана С2Н6;
г) 4 л веселящего газа N2О или 4 л бурого газа NО2;
д) 8 л водорода или 1 л азота N2?
38. Установите соответствие между объемом газа и числом молекул.
Объем газа Число молекул
1) 11,2 л; А. 6 · 1026 молекул;
2) 2,8 л; Б. 1,5 · 1023 молекул;
3) 22,4 м3; В. 75 · 1021 молекул;
4) 5,6 л. Г. 3 · 1023 молекул.
Определение плотности вещества. Вычисление молярной массы по плотности
Определение плотности вещества.
Вычисление молярной массы по плотности
Задача 1. Какова плотность ацетилена С2Н2 при н. у.?
Краткая запись условия задачи:

Решение:
М(С2Н2) = 12 · 2 + 1 · 2 = 26 г/моль;
r(С2Н2) =  = 1,16 г/л...
= 1,16 г/л...
Ответ : r(С2Н2) =1,16 г/л.
Задача 2. Плотность газа равна 0,09 г/л. Какова его молярная масса?
Краткая запись условия задачи:

Решение:
М = r · Vm; М = 0,09 г/л · 22,4 л/моль = 2 г/моль.
Ответ: М(газа) = 2 г/моль.
Задача 3. 0,7924 г хлора при 0° С и Р = 101,325 кПа занимают объем, равный 250 мл. Вычислите молярную массу хлора.
Краткая запись условия задачи:

Решение:
m(Cl2) =  = 71 г; М(Cl2) = 71 г/моль.
= 71 г; М(Cl2) = 71 г/моль.
Ответ: М(Cl2) = 71 г/моль.
По закону Авогадро, равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержат равное число молекул.
Отсюда: массы равных объемов двух газов должны относиться друг к другу, как их молярные массы: 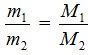 .
.
Отношение массы данного газа к массе того же объема другого газа, взятого при той же температуре и том же давлении, называется относительной плотностью первого газа по второму (Д).
![]() – это Д; Д =
– это Д; Д = ![]() , М1 = Д · М2.
, М1 = Д · М2.
Задача 4. Какова относительная плотность углекислого газа по водороду? по воздуху?
Краткая запись условия задачи:

Решение:
Д(СО2)Н2 = ![]() = 22; Д(СО2)возд. =
= 22; Д(СО2)возд. = ![]() = 1,5.
= 1,5.
Ответ: углекислый газ тяжелее водорода в 22 раза, а воздуха – в 1,5 раза.
Определение массы и объема смеси по плотности
Определение массы и объема смеси
по плотности
Задача 1. Плотность раствора серной кислоты 1,8 г/мл. Какова масса 300 мл этого раствора?
Краткая запись условия задачи:

Решение:
m(р-ра Н2SO4) = 1,8 г/мл · 300 мл = 540 г.
Ответ: m(р-ра Н2SO4) = 540 г.
Задача 2. Какой объем занимают 200 г раствора азотной кислоты НNО3, плотность которого 1,2 г/мл?
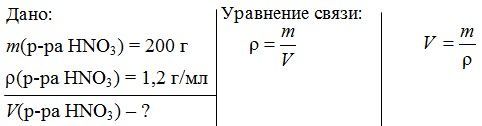
Решение:
V(р-ра НNО3) =  = 166,7 мл.
= 166,7 мл.
Ответ: V(р-ра НNО3) = 166,7 мл.
Задачи для самостоятельного решения.
39. Определите плотность при н. у. следующих газов:
а) сернистого газа SО2; д) бурого газа NО2;
б) кислорода О2; е) фтора F2;
в) азота N2; ж) озона О3.
г) метана СН4;
40. Определите молекулярную массу следующих газов по их плотности:
а) плотность фтороводорода НF – 0,89 г/л;
б) плотность силана SiH4 – 1,43 г/л;
в) плотность аммиака NН3 – 0,76 г/л;
г) плотность угарного газа СО – 1,25 г/л;
д) плотность фосфина РН3 – 1,52 г/л.
41. Определите относительную плотность газов из задания № 1 по водороду и по воздуху.
42. Поместится ли в литровой бутылке:
а) 1 кг воды;
б) 1 кг серной кислоты (r = 1,84 г/мл);
в) 1 кг спирта (r = 0,8 г/мл);
г) 1 кг азотной кислоты (r = 1,2 г/мл)?
43. Верны ли следующие суждения:
А. 3 моль кислорода содержат 18 · 1023 молекул и занимают объем 67,2 л.
Б. Метан СН4 в 2 раза легче кислорода.
1) Верно только А; 3) оба суждения верны;
2) верно только Б; 4) оба суждения неверны.
44. На чашу весов поместили 192 г меди. Какое число молекул серы могут уравновесить весы?
Товар размещен в разделах
QR-код страницы
Для партнеров
с учмагом












