Химия. 8-9 классы: поурочные планы по учебникам О. С. Габриеляна. Программа для установки через Интернет
| Код | СИ-380.2 |
| Авторы | Денисова В. Г. |
| Издательство | Учитель, 2025 |
| Серия | Поурочное планирование |
| Электронная версия | скачать |
Инструкция по оплате и установке электронной продукции через Интернет: ознакомиться.
Покупка одного экземпляра программы дает право её использования на одном ПК.
- Габриелян, О. С. Химия. 8 класс : учеб. для общеобразоват. учреждений / О. С. Габриелян. - М. : Дрофа, 2011;
- Габриелян, О. С. Химия. 9 класс : учеб. для общеобразоват. учреждений / О. С. Габриелян. - М. : Дрофа, 2011.
Материал составлен в соответствии с требованиями программы основного общего образования, разбит по классам и темам.
На диске содержатся основные теоретические сведения, разнообразный дидактический материал (карточки, таблицы, схемы, задания творческого характера), уроки-зачеты с матрицей ответов, проверочные работы с многовариантными заданиями, практические и контрольные работы.
Компакт-диск будет полезен учителям при составлении тематических планов, при поурочном распределении учебного материала, наполнении уроков различными формами и видами работ, а также при составлении контрольных и проверочных работ, организации демонстрационного эксперимента, лабораторных опытов и практических работ.
С этим товаром покупают
Примеры документов
Урок 1. Предмет химии. Вещества
урок 1
предмет химии. вещества
Элементы содержания из Примерной программы основного общего образования по химии: химия как часть естествознания; химия – наука о веществах, их строении, свойствах и превращениях; химический элемент; простые и сложные вещества; атомы и молекулы.
Требования к уровню подготовки выпускников основной общеобразовательной школы: знать понятия «вещество», «химический элемент».
Материалы и оборудование: стеклянные колба, стакан, пробирка, образцы металлических пластинок (медная, алюминиевая, железная), образцы неметаллов (сера, уголь, фосфор), вода в стакане, кристаллы медного купороса, поваренной соли, сахара; раствор медного купороса, стальной гвоздь, модели кристаллических решеток алмаза, углекислого газа.
Ход урока
Урок строится в форме эвристической беседы.
Основные задачи беседы – выяснить:
1) какое место занимает химия среди других наук;
2) что она изучает;
3) что такое вещество;
4) чем одно вещество отличается от другого;
5) в чем причина этих отличий.
Вопросы учителя:
– Я сейчас назову три группы наук. А вы попытайтесь определить, к какой из них ближе химия:
1. Литературоведение, лингвистика, история.
2. Математика, информатика.
3. Физика, биология.
(Ответ: 3.)
– Как называются эти науки?
(Ответ: естественные.)
– Что является предметом изучения биологии? физики?
(Ответ: живое; физические явления.)
– Какие вы знаете физические явления?
(Ответ: механические, тепловые, электромагнитные, звуковые, световые.)
– С чем происходят эти явления?
(Ответ: с физическими телами.)
– Из чего стоят физические тела?
(Ответ: из атомов, молекул, из вещества.)
– Как вы думаете, что изучает химия?
(Ответ: вещества.)
– Что о веществах должна знать химия?
Учитель демонстрирует модели кристаллических решеток.
(Ответ: химия должна знать, из чего состоят вещества.)
– Давайте попробуем дать ответ на этот вопрос. Посмотрите на решетку алмаза и углекислого газа. В чем отличие? Что это за частицы?
(Ответ: у алмаза – атомы, у углекислого газа – молекулы.)
– А из чего состоят молекулы?
(Ответ: из атомов.)
– Значит, мельчайшей частицей вещества является атом? Как вы думаете, все ли атомы одинаковы?
(Ответ: нет.)
– Чем они могут различаться?
(Ответ: размером, массой.)
– Верно. А также они различаются своим составом: зарядом ядра, числом электронов. – А есть ли в природе одинаковые атомы?
(Ответ: да.)
Одинаковые атомы, или атомы одного вида, принято называть химическим элементом. Всем вам известна таблица химических элементов – таблица Д. И. Менделеева, в ней показаны все существующие разновидности атомов.
– Давайте еще раз посмотрим на кристаллическую решетку алмаза. Все ли атомы в ней одинаковы?
(Ответ: да.)
Такие вещества, состоящие из атомов одного химического элемента, называют простыми.
– Из скольких химических элементов состоит углекислый газ?
(Ответ: из 2.)
– Как будет называться группа веществ, к которым относится углекислый газ?
(Ответ: сложные вещества.)
– Попытайтесь дать определение сложным веществам.
– Итак, давайте подведем итог нашей беседы и коротко запишем в тетрадь:
· Химия изучает вещества.
· Вещество состоит из атомов и молекул.
· Вещество может быть простым (состоит из атомов одного химического элемента) и сложным (состоит из атомов нескольких химических элементов).
– Что же такое вещество?
Урок 2. Превращение вещества. Роль химии в жизни человека
урок 2
превращение вещества.
роль химии в жизни человека
Элементы содержания: химическая реакция, наблюдение, описание, эксперимент.
Требования: знать важнейшее химическое понятие «химическая реакция».
Материалы и оборудование: парафиновая свеча, спички, пробирка с парафином, спиртовка, зажим, фарфоровая чашка, большой стакан, известковая вода, медная пластинка, стакан с водой.
Ход урока
I. Проверка домашнего задания (проводится в форме фронтальной беседы).
– Что такое химия; вещество, химический элемент, простое, сложное вещество?
– Каковы физические свойства воды?
– Проверка упражнений 3, 6, 8, 9.
Упражнения:
1. Перечислите 5 физических тел, которые могут быть сделаны из железа (гвоздь, скрепка, кнопка, чайник, ложка), из стекла (стакан, графин, бусы, зеркало, линза), из пластмассы (ручка, линейка, стакан, пакет, цветочный горшок).
2. Назовите по 2–3 вещества, из которых могут быть сделаны школьные линейки (дерево, железо, пластмасса), стаканы (стекло, керамика, пластмасса).
3. Учитель демонстрирует классу медную пластину, просит назвать физические свойства меди, демонстрирует пластичность меди, сгибая пластинку, и ее нерастворимость в воде.
4. Об элементе или веществе говорится в предложении: «Сера – желтый не смачиваемый водой порошок»?
5. Давайте вернемся к упражнению 6 (с. 11) и определим по рисункам для каждого вещества:
– Что изображено: атом или молекула?
– Из скольких атомов состоит молекула?
– Из скольких химических элементов состоит каждая молекула?
II. Изучение новой темы.
Учитель сообщает, что мы живем в мире явлений. Явления эти разнообразны. Рассмотрим два явления. Учитель демонстрирует плавление парафина, затем выливает его в воду, достает из воды кусочки парафина. Задает вопросы классу: что произошло с парафином? Превратился ли он в другое вещество? Такие явления называют физическими.
Теперь подожжем парафиновую свечу. Внесем в ее пламя фарфоровую чашку. Что с ней стало? Накроем свечу большим стаканом, стенки которого смочены известковой водой; что наблюдаем?
На парафиновой чашке появилась копоть – вещество черного цвета, известковая вода помутнела, что говорит о выделении углекислого газа. Образовались ли новые вещества в этом случае? Такие явления называют химическими.
Кратко запишем в тетрадь:

Люди в древности сталкивались с физическими и химическими явлениями, наблюдали, делали выводы и заставляли явления служить себе. Так было с огнем – явление горения. На современном этапе человек изучает более тонкие, скрытые явления, такие как биосинтез белка, обмен веществ в организме, фотосинтез.
– Какими же методами пользуется человек для изучения явлений?
Самый первый метод – наблюдение, за ним следует – описание. В развитии каждой естественной науки есть описательный этап. Он приводит к накоплению большого количества сведений, из которых можно сделать выводы, а также возникает необходимость классификации. Таким образом описательная наука превращается в систему.
Для более подробного, точного изучения явления требуется его многократное повторение. Так возникает необходимость в эксперименте и моделировании, если процесс сложный и трудно воспроизводимый.
Химия – экспериментальная наука. Поэтому вам нужно знать правила безопасного проведения эксперимента, а также приемы работы с химическим оборудованием.
Поэтому следующий наш урок будет посвящен практической работе.
Домашнее задание: читать введение и § 2, устно выполнить упр. 1–5 (через урок), ознакомиться с практической работой (с. 174), принести к следующему уроку чистую тетрадь в клетку (12, 18 листов).
Урок 3. Практическая работа "Приемы обращения с лабораторным оборудованием"
урок 3
практическая работа
«приемы обращения с лабораторным
оборудованием»
Элементы содержания: правила работы в школьной лаборатории; лабораторная посуда и оборудование; правила безопасности.
Требования: использовать приобретенные знания и умения для безопасного обращения с веществами и материалами; уметь обращаться с химической посудой и лабораторным оборудованием.
Оборудование: демонстрационное: лабораторный штатив, спиртовка, зажим, пробирка, колбы, стаканы, фарфоровая чашка, воронка, фильтр, мерный цилиндр; на столах учащихся – штатив, спиртовка, пробирка, зажим, спички, трафарет химический.
Ход урока
I. Первый этап урока.
Обсуждение правил техники безопасности при работе в кабинете химии, заполнение журнала по технике безопасности.
II. Второй этап урока.
Учащиеся подписывают тетради для практических работ. Знакомство с лабораторным оборудованием.
Учитель демонстрирует химическую посуду (пробирки, колбы, стакан, воронку с фильтром, мерный цилиндр, фарфоровую чашку), поясняет ее предназначение.
Учащиеся с помощью химического трафарета зарисовывают посуду, подписывают названия и предназначение.
Затем учащиеся учатся закреплять пробирку в штативе на разной высоте в разном положении, зарисовывают штатив, подписывают его части.
Далее – учатся зажигать и гасить спиртовку, закреплять пробирку в зажиме, правильно нагревать пробирку на спиртовке. Зарисовывают спиртовку в тетрадь, указывают зоны пламени.
III. Закрепление пройденного материала.
Можно предложить учащимся найти ошибки в поведении ученика в следующем рассказе.
Вовочка пришел на урок химии и узнал, что у него сегодня практическая работа. Как только учитель раздал реактивы, Вовочка снял крышки со всех пузырьков и начал сливать реактивы в один стакан. Затем он высыпал щепотку кристаллов медного купороса в руку, понюхал и бросил в тот же стакан. Через некоторое время Вовочка заглянул в стакан, чтобы проверить, как протекает реакция, в нос ему ударил резкий запах, он дернулся, задел локтем пузырьки с веществами, они упали на пол. Вовочка бросился руками собирать осколки и рассыпавшиеся вещества. Тут терпение учителя кончилось...
(Ответ:
1) С инструкцией по выполнению работы нужно знакомиться заранее.
2) Работать с веществами нужно строго по инструкции.
3) Нельзя использовать бóльшие количества вещества, чем это необходимо по инструкции.
4) Нельзя держать реактивы открытыми и путать крышки.
5) Нюхать вещества можно только на расстоянии.
6) Нельзя заглядывать сверху в сосуд, в котором идет реакция, можно получить ожог глаз и кожи лица.
7) Работать нужно спокойно, без суеты.
8) Нельзя руками собирать осколки и вещества.)
Домашнее задание: § 2, введение.
Урок 4. Химия: с древности до наших дней
урок 4
химия: с древности до наших дней
Элементы содержания: Периодическая система химических элементов, группы и периоды Периодической системы химических элементов.
Оборудование: Периодическая система (на столах учащихся).
Ход урока
I. Проверка домашнего задания (в форме фронтального опроса).
– Какие явления называются физическими, химическими? Приведите примеры (упр. 1).
Проверка упражнений 2–5. Как вы поняли, что такое наблюдение, описание, эксперимент, моделирование?
II. Изучение нового материала (в форме рассказа учителя и беседы).
(Можно привлечь диафильм или видеофильм об истории химии.)
По всей видимости, химия зародилась в Древнем Египте, где за 3–4 тысячи лет до нашей эры получали металлы, стекло, керамику, краски и духи.
Очень долго шел этап накопления химических сведений, на основании которых в V веке до н. э. Демокрит высказал идею об атомах.
Древние химики умели проводить не только наблюдения и описания, они ставили эксперименты, путем проб и ошибок, а иногда случайно, получали нужные им вещества. Объяснить, как и почему происходят превращения веществ, они не могли.
В Средние века появляется наука – алхимия, целью которой является превращение всех металлов в золото с помощью философского камня.
Алхимики также пытались получить эликсир вечной молодости и универсальный растворитель. Их цели, как мы теперь понимаем, были антинаучны. Но алхимики принесли очень много пользы для развития медицины, промышленности, методов работы с веществами. Они изобретали новые химические приборы и открывали химические вещества и элементы.
В XVIII веке ученые пытались объяснить причины происходящих с веществами изменений.
Огромен вклад в химическую науку М. В. Ломоносова: он продолжил развитие атомно-молекулярного учения и сформулировал закон сохранения массы веществ: «масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате ее». На основании чего становилось понятно, что сущность химической реакции заключается в перегруппировке атомов веществ, вступивших в нее.
К середине XIX века человечеству было известно 63 химических элемента, возникла необходимость систематизации знаний о них. В 1869 г. Д. И. Менделееву удается создать систему химических элементов, в которой каждому элементу нашлось место в соответствии с выведенной Д. И. Менделеевым закономерностью. Эта таблица элементов дополняется по сей день. Теперь уже люди не ищут химические элементы в природе, а сами синтезируют их.
Периодическая система – главный справочник химика, и вы должны научиться пользоваться им.
Для этого давайте рассмотрим структуру периодической системы. У каждого элемента – своя «клетка», в которой указаны: название и символ элемента, его порядковый номер и масса. «Клетки» имеют свои координаты по вертикали и горизонтали. Они называются периодами (горизонтальные ряды), их 7, в 1-м периоде – 2 элемента, во 2 и 3-м – по 8, в 4 и 5-м по 18, в 6-м – 32, в 7-м также будет 32 элемента. Группы – вертикальные столбцы, их 8. Они делятся на подгруппы: главные и побочные. В главные подгруппы входят элементы с 1-го по 7-й периоды, а в побочные – только начиная с 4-го периода.
Вы должны уметь определять «координаты» химических элементов и находить элемент по заданным координатам.
III. Игра «Цепочка».
Учитель называет координаты, первый ответивший ученик имеет право назвать следующий элемент или его координаты и т. д.
Домашнее задание: читать § 3, 4, упр. 5 (письменно).
Урок 6. Относительные атомная и молекулярная массы
урок 6
относительные атомная
и молекулярная массы
Элементы содержания: относительная атомная и молекулярная массы, атомная единица массы.
Требования: уметь вычислять относительную молекулярную массу веществ и массовую долю элемента в веществе по формуле соединения.
Оборудование: Периодические системы химических элементов (на столах учащихся).
Ход урока
I. Проверка домашнего задания.
– Что такое химический знак? Химическая формула? Индекс? Коэффициент?
Проверка упр. 1, 2, 4. Опрос учащихся по знакам неметаллов у доски.
II. Объяснение нового материала.
Мы с вами уже выяснили, чем отличаются атомы химических элементов: составом, размерами, массой. Как же измеряется масса столь маленьких частиц? В граммах она ничтожно мала. Например, масса атома водорода 1,674 · 10-24 г, а кислорода – 2,667 · 10-23 г. Такими значениями пользоваться не очень удобно, поэтому за единицу массы была принята масса самого легкого атома – водорода. Все атомные массы разделили на массу атома водорода. Так и получились относительные атомные массы Ar. Они не имеют единицы измерения и показывают, во сколько раз данный атом тяжелее атома водорода.
Иногда массу атома водорода принимают за атомную единицу массы а. е. м. и выражают относительную атомную массу в этих единицах Ar (О) = 16 а. е. м.
Из атомов складываются молекулы, массы молекул называются относительные молекулярные массы Mr, они рассчитываются как суммы атомных масс всех атомов, входящих в молекулу.
Работа в тетради с периодической системой: учащиеся выписывают округленные Ar из Периодической системы в таблицу в своей тетради. Через 2–3 минуты работа проверяется.
Далее учитель объясняет, как рассчитать Mr вещества.
Mr (H2O) = Ar (H) · 2 + Ar (O) = 1 · 2 + 16 = 18;
Mr (H2SO4) = Ar (H) · 2 + Ar (S) + Ar (O) · 4 = 1 · 2 + 32+16 · 4 = 98;
Mr (Al2(SO4)3) = Ar (Al) · 2 + (Ar (S) + Ar (O) · 4) · 3 = 27 · 2 + (32 + 16 · 4) · 3 = 342.
Описать состав вещества можно не только формулой, но и через массовые доли элементов в веществе.
Массовая доля (ω – «омега») элемента рассчитывается в долях единицы или в процентах и показывает, какая часть массы вещества приходится на данный элемент.
 ,
,
где n – число атомов элемента в веществе.
Например:
в воде 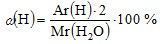 ;
;
![]() ;
;
в H2SO4  ;
;
в Al2(SO4)3 
![]() 56,14 %.
56,14 %.
Если остается время, на уроке можно выполнить несколько упражнений на расчет Mr и ω(Э).
Домашнее задание: § 5 (до конца), упр. 3, 6, 7, 8 (письменно). Принести чистые тетради в клетку (12, 18 листов), учить знаки химических элементов – металлов.
Товар размещен в разделах
QR-код страницы
Для партнеров
с учмагом








